近日,美國食品藥品監督管理局(Food and Drug Administration;簡稱FDA)官網公布:貝達藥業以零缺陷(no 483)的結果順利通過美國FDA對鹽酸恩沙替尼的批準前檢查(Pre-Approval Inspection, 簡稱PAI)。這是貝達藥業首次通過美國FDA審計,標志著貝達藥業質量管理體系獲得國際權威藥監機構的認可,對公司國際化具有里程碑意義。
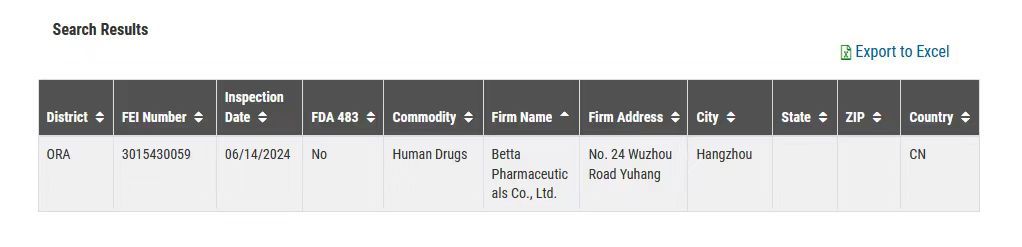
△來源:FDA官網
FDA是美國聯邦政府機構,負責監管和批準食品、藥品、化妝品、醫療器械等產品的安全性和有效性,是公認的全球藥品質量監管最權威、最嚴格的機構之一。
2024年6月11日至14日,貝達藥業合成基地接受了FDA針對公司原料藥鹽酸恩沙替尼的PAI現場核查,全面涵蓋了cGMP體系的質量、生產、實驗室控制、廠房設施與設備、物料、包裝與標簽六大系統,以及數據完整性管理體系。
在末次會議上,FDA檢察官對貝達藥業良好的生產質量管理體系給予了高度評價,認定貝達藥業已建立了完善的cGMP質量管理體系,配備了相應的技術管理人員,具備完善的生產和檢驗設施設備。
貝達藥業副總裁馬勇斌表示,這是公司首次迎接美國FDA現場檢查,也是恩沙替尼海外獲批上市的一個關鍵環節。合成基地順利通過FDA現場審查,離不開質管部、生產中心各位同事的充分準備,也離不開公司跨部門的鼎力幫助,零缺陷的結果通過證明貝達藥業的合成基地已具備為美國市場提供商業化創新藥原料藥(API)的資質,期待恩沙替尼能早日在美國獲批上市,為全球患者提供新的用藥選擇。
貝達藥業董事長丁列明博士表示,這一里程碑式的成就不僅是對公司生產質量管理體系的一次檢驗和認可,證明了貝達擁有符合國際標準的質量體系,能夠為藥物上市提供堅實的質量保證,也是貝達全球化進程的有力保障,為我們的產品走向國際市場、提升國際競爭力奠定了堅實基礎。未來,貝達將繼續秉承“一流的質量、一流的技術、一流的品牌”的理念,不斷提升研發創新能力,加強質量管理體系建設,為后續打開國際市場做好充分準備,給全球患者提供更多優質、安全的藥品。
下一條: 恩沙替尼術后輔助III期臨床研究完成IB-IIIB期受試者入組
